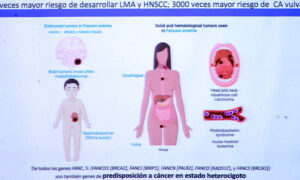
Los eventos adversos más frecuentes con emicizumab fueron reacciones en el sitio de inyección cabe señalar que no se observaron nuevas señales de seguridad
BASILEA, Suiza.- La Agencia de Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) otorgó la designación de terapia innovadora a emicizumab, tratamiento para pacientes con hemofilia A sin inhibidores del factor VIII.
La designación de terapia innovadora se asigna para acelerar el desarrollo y revisión de medicamentos para padecimientos graves que pueden demostrar una mejora sustancial con respecto a las terapias disponibles actualmente.
“Emicizumab es el primer medicamento que muestra, en una comparativa intra-paciente, una eficacia superior en comparación con la profilaxis con agentes del factor VIII, el estándar de atención actual para personas con hemofilia A sin inhibidores”, dijo la doctora Sandra Horning, directora médica de Roche y directora de Global Desarrollo de productos.
“En este contexto, esperamos colaborar con las autoridades sanitarias para que emicizumab esté disponible para los pacientes lo antes posible. Nos complace compartir esta noticia en el marco del Día Mundial de la Hemofilia”, expresó.
Esta designación se basa en los resultados obtenidos del estudio fase III, HAVEN 3, en pacientes de 12 años o mayores con hemofilia A sin inhibidores.
En el estudio, la infusión de emicizumab administrada por vía subcutánea cada semana o cada dos semanas mostró una reducción estadística y clínicamente significativa en las hemorragias tratadas en comparación con los pacientes que no recibieron ninguna profilaxis.
En un comparativo intra-paciente, la infusión subcutánea de emicizumab una vez a la semana fue superior a la profilaxis previa con agentes del factor VIII, tal y como se demostró en la reducción estadística y clínicamente significativa de en las hemorragias tratadas.
Los eventos adversos más frecuentes con emicizumab fueron reacciones en el sitio de inyección, cabe señalar que no se observaron nuevas señales de seguridad. Asimismo, no se produjo microangiopatía trombótica o eventos trombóticos en este estudio.
En septiembre de 2015, emicizumab recibió la primera designación como terapia innovadora y fue aprobada por la FDA, en noviembre de 2017, como tratamiento profiláctico de rutina para prevenir o reducir la frecuencia de episodios de hemorragia en adultos y niños con hemofilia A con inhibidores del factor VIII, según los resultados de los estudios HAVEN 1 y HAVEN 2.
Recientemente, emicizumab también fue aprobado por las autoridades regulatorias en otros países del mundo, incluida la Comisión Europea que dio su autorización en febrero de 2018, como terapia profiláctica de rutina para los episodios de hemorragia en personas con hemofilia A con inhibidores del factor VIII.
El programa de desarrollo de emicizumab refleja el compromiso de Roche para abordar las necesidades clínicas no cubiertas en las personas que viven con hemofilia A.